小克里斯滕森氏菌——下一代益生菌候选者:改善代谢、减轻炎症
小克里斯滕森氏菌(Christensenella minuta)是一种革兰氏阴性、不产生孢子、不运动的细菌:它属于厚壁菌门,这是细菌界中最大的门之一,包括多种对人类健康有重要影响的细菌。
在厚壁菌门下,C.minuta属于梭菌纲,这一纲的细菌多为厌氧菌,能在缺氧的环境中生长。梭菌目是梭菌纲下的一个目,包含了多种与消化道健康密切相关的细菌。
在梭菌目下,C.minuta属于Christensenellaceae属,这是一个与肠道健康紧密相关的科。由Christensenella minuta和少数其他菌种组成的属。
Christensenella minuta于2012年首次从健康人类粪便中发现,被认为是新一代益生菌。克里斯滕森菌科(Christensenellaceae)及其成员Christensenella minuta已被证明具有许多健康益处。
研究表明,Christensenella minuta在2型糖尿病和肥胖等代谢紊乱以及炎症性肠病中的丰度显著下降。其相对丰度与低 BMI 指数相关的瘦表型呈正相关。
除此之外,支气管哮喘和过敏性疾病、肾结石、情感障碍、甲状腺癌、粘膜类天疱疮、多囊卵巢综合征和复发性口疮性口炎等疾病中Christensenella minuta的丰度也较低。
Christensenella minuta能够代谢多种碳水化合物,例如纤维素、半纤维素和果胶,产生乙酸和丁酸等短链脂肪酸,这些物质不仅对肠道健康有益,还能调节宿主的代谢过程。
C.minuta通过几种机制影响代谢健康,包括使肠道微生物群重新正常化、产生功能性短链脂肪酸、抑制脂肪生成、维持肠道上皮完整性以及通过胆汁酸代谢调节能量代谢。
此外,C.minuta还通过抑制NF-κB信号通路和促炎细胞因子IL-8的分泌来缓解炎症性肠病。
C.minuta还可能对患有过敏性疾病的患者大有裨益,因为它可以改善肠道通透性并减轻全身炎症。而患有哮喘、湿疹和食物过敏的患者更容易出现“肠漏”,这被认为是导致疾病发病和诱发病情的一个因素。
鉴于其能够限制肠道干细胞增殖,未来C.minuta衍生的益生菌也可能对恶性肿瘤患者有益,尤其是结肠癌患者。
此外,Christensenella minuta显示出与其他潜在有益菌株的强烈相关性;由于C.minuta能够产生短链脂肪酸或塑造酸性环境,有利于其他有益菌(如Akkermansia muciniphila和Roseburia faecis)或与传统益生菌菌株(如双歧杆菌和乳酸杆菌)的生长,C.minuta还能够产生氢气,为M.smithii提供代谢底物(它利用H2和CO2产生甲烷),同时会抑制如克雷伯菌、大肠杆菌等机会性病原体的定值和增殖。
本文从基本属性、人群分布、Christensenella minuta的丰度与一些人体疾病(如肥胖、炎症性肠病和 2 型糖尿病)中的关联,以及与其他细菌的相关性,讲述了可能成为新一代益生菌的Christensenella munita。更好的了解Christensenella可以为基于肠道微生物群的个性化药物或疗法铺平道路。
01 发现历史和基本属性
▸ 发现历史
小克里斯滕森氏菌(Christensenella minuta)(DSM 22607) 于2012年通过 16S rRNA 测序发现,并首次从健康日本男性的粪便样本中培养出来。
2021年,发现了另一个C.minuta菌株DSM33407。其序列与菌株DSM22607有 99% 的一致性,并表现出相似的微生物学特性。次年,另一株菌株C.minuta DSM 33715 被公布并登记。
此外发现了两个新的细菌物种Christensenella massiliensis和Christensenella timonensis ,经 16S rRNA 测序,它们与C. minuta的序列相似性分别为 97.4% 和 97.5%。
而Caldicoprobacter oshimai JW/HY-331 T、Tindallia californiensis DSM 14871 T和Clostridium ganghwense JCM 13193 T是最近的亲属。
▸ 基本属性
从分类学上讲,Christensenella minuta属于厚壁菌门、梭菌纲和梭菌目。该细菌以丹麦微生物学家 Henrik Christensen 的名字命名,其种名反映其小巧的体型(Minuta在拉丁语中是“小”的意思)。该菌株的基因组相对较小,由大约150万个碱基对组成。
Christensenella minuta的细胞形态
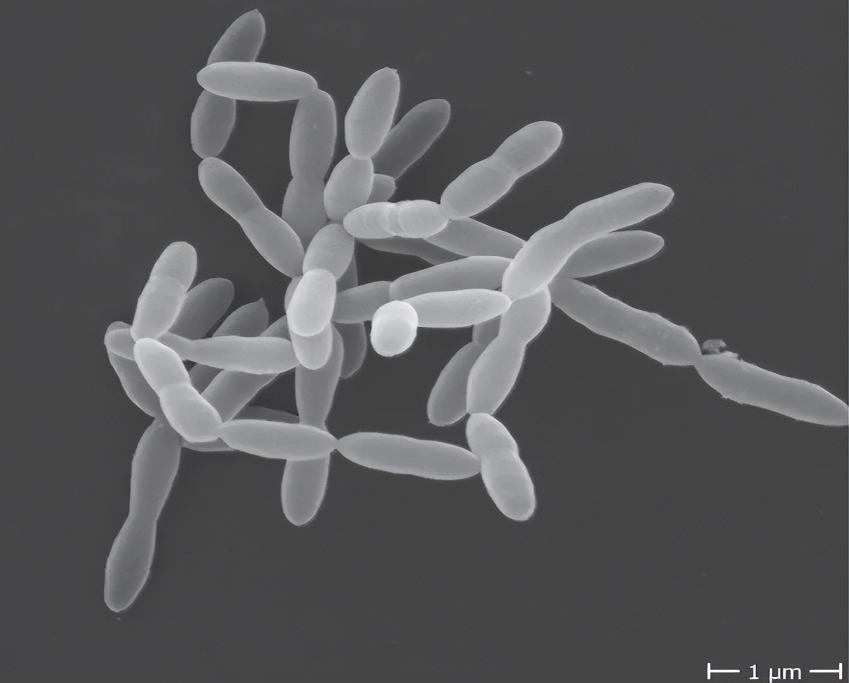
Christensenella minuta是一种小型杆状细菌,末端呈锥形、大小从0.5毫米到1.9毫米不等、革兰氏阴性、不产生孢子、不运动的细菌,可形成圆形、几乎无色的菌落。菌落的平均尺寸为:宽度0.507±0.04μm、长度1.27±0.28μm、直径0.5–1.0μm,单独或成对出现。
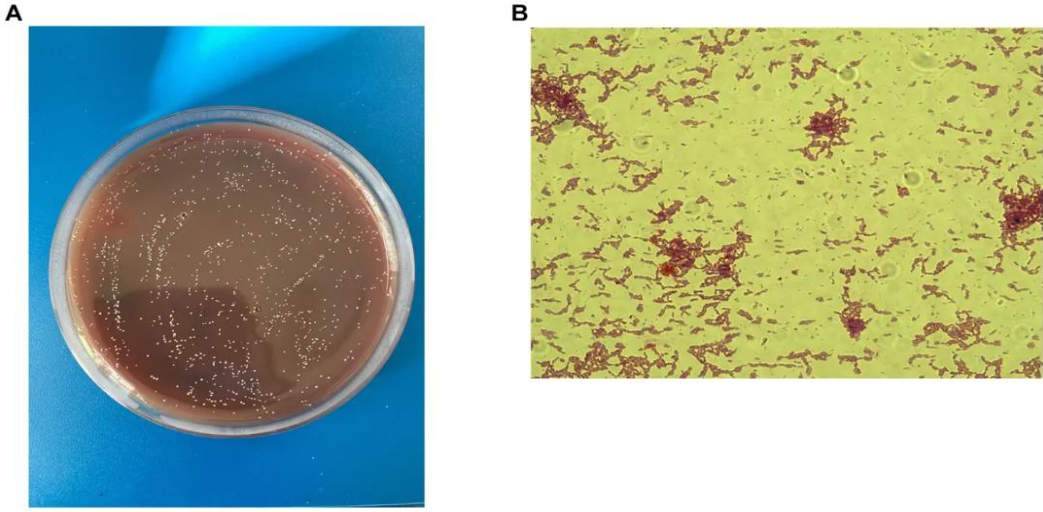
A)革兰氏染色;B)在Schaedler琼脂上生长的菌落
-暴露于空气中会显著降低活性
它最初被描述为严格厌氧的;然而,后来的研究表明,它可以耐受氧气数小时。与普遍看法相反,暴露在大气中不会立即杀死细菌,而是会降低其活力。Christensenella minuta在37–40°和pH7.5时生长最快。它不是特别挑剔,可以在各种培养基中生长。
Christensenella minuta具有边界清晰的细胞壁,由丙氨酸、谷氨酸、丝氨酸和LL-二氨基庚二酸组成,这些细胞壁与半乳糖、葡萄糖、鼠李糖和核糖作为全细胞糖连接。
-对氨苄西林和四环素有抗性
菌株DSM22607的胆汁抗性为20%,而菌株 DSM33715的胆汁抗性高达80%。
对氨苄西林和四环素有抗性,但对氯霉素、克林霉素、美罗培南、甲硝唑、莫西沙星和哌拉西林/他唑巴坦敏感。
-可以利用多种单糖,但无法代谢色氨酸
在碳源利用方面,Christensenella minuta显示出对多种碳水化合物的利用能力,包括纤维素、半纤维素和果胶等。这些碳水化合物在肠道中不易被宿主消化酶分解,但C. minuta能够通过其独特的酶系统进行发酵,从而获取能量和营养物质。
C.minuta可以利用多种单糖,如葡萄糖、D-木糖、L-阿拉伯糖、L-鼠李糖和D-甘露糖,进行糖酵解发酵。C. minuta对葡萄糖的主要发酵产物是短链脂肪酸(乙酸和丁酸)。此外,已证明它可以通过发酵转化有机底物以产生大量氢气。
C. minuta对过氧化氢酶、氧化酶和脲酶的检测结果均为阴性。它也不能还原硝酸盐,也不能代谢色氨酸。最近, C. minuta菌株之一 DSM 22607被证明能产生一种新型胆盐水解酶(BSH)。
02 在人群的分布
克里斯滕森菌科(Christensenellaceae)成员遍布各大洲。它们生活在各种动物的微生物群中,从蟑螂和蜥蜴到鸟类和哺乳动物,包括人类。这些细菌主要存在于胃肠道中,但也存在于灵长类动物的呼吸道和泌尿生殖道。
▸ 不同种族和性别之间丰度差异显著
Christensenella minuta作为健康成人结肠中的亚优势共生微生物种群,约占细菌总种群的0.2%到2%。其流行率在个体之间差异很大。在人群中,与克里斯滕森菌科(Christensenellaceae)不同相对丰度相关的特征包括种族和性别。
例如,对居住在阿姆斯特丹的2000多名不同种族的个体进行了研究,报告称荷兰受试者的Christensenellaceae科相对丰度最高。同样,比较了1673名居住在美国的人种族间微生物组差异,报告称与其他种族相比,亚太岛民的粪便样本中Christensenellaceae科的总体代表性较低。
一项研究还发现,与男性相比,女性中Christensenellaceae的相对丰度更高,在动物中也报告了类似的观察结果。这些种族和性别差异的根本原因尚不清楚。
▸ 百岁老人和瘦体型的人群中丰度更高
还有研究表明,在中国、意大利和韩国等国,百岁老人和超百岁老人体内的Christensenellaceae相对丰度高于年轻人群,因此Christensenellaceae可能与人类长寿有关。
针对多个地理位置的相对年轻个体的研究也发现了Christensenellaceae与年龄的正相关的关系 。鉴于这些研究均未对同一个体进行长期跟踪,因此 Christensenellaceae 与年龄的关联可能反映的是队列效应,而非年龄效应。
例如,随年龄而变化的饮食模式可能会影响这种关联,或者较早出生的个体体内的Christensenellaceae含量可能一直高于较晚出生的个体。
基于 16S rRNA 基因的肠道微生物群检测,该菌群在瘦体型个体中较为丰富。M.smithii是最丰富的产甲烷菌,它利用H2和CO2(C.minuta细菌发酵膳食纤维的产物)产生甲烷,表明以H2为基础的共营养与瘦表型和健康状态相关。这表明C.minuta和M.smithii之间存在跨物种氢转移,并且这两个物种与瘦表型呈正相关。
▸ 炎症性肠病等疾病中丰度降低
研究发现,C. minuta在健康个体的肠道微生物群中普遍存在,但在患有炎症性肠病(IBD)等特定疾病的个体中,其丰度显著降低。
这种分布的差异性提示了C. minuta在维持肠道健康和预防疾病方面可能具有重要作用。
03 与健康或不同疾病的关联
越来越多的研究揭示了Christensenella minuta在人体健康和疾病中的重要作用。Christensenellaceae与多种代谢过程密切相关。研究表明,这种细菌在调节宿主的能量平衡、脂质代谢、脂多糖代谢、抗炎作用以及维持肠道屏障功能方面发挥着关键作用。
进一步的研究还发现,Christensenellaceae的丰度与肥胖、糖尿病、炎症性肠病等多种疾病的风险呈负相关。它还与健康衰老有关。在短短10年内,已经积累了大量证据表明,Christensenellaceae在许多疾病中显著减少。
▸ 肥胖患者中减少 ↓
肥胖是一种复杂的疾病,由体内过多的脂肪堆积引起,会对身体健康产生不利影响。许多非传染性疾病,如心血管疾病、各种癌症、2 型糖尿病、高血压和中风,以及精神健康问题都与肥胖有关。
研究认为,肥胖的病因与肠道菌群失调和先天性瘦素缺乏有关。已提出了几种机制将肥胖的发生与肠道菌群组成联系起来,这些机制是通过代谢和炎症活动的功能障碍实现的。
肥胖的发生涉及肠道菌群和宿主,是通过与近端器官的直接相互作用或通过代谢物分泌与肝脏、脂肪组织和大脑等远处器官的间接相互作用介导的。
在许多研究中,C. minuta被反复与其治疗性抗肥胖潜力联系在一起,这表明C. minuta在肠道微生物生态系统中的作用与宿主代谢的调节之间存在很强的相关性。C. minuta发挥治疗性抗肥胖作用的机制包括调节肠道上皮完整性、产生短链脂肪酸、改善脂质代谢和胆汁酸代谢。
-产生短链脂肪酸来调节能量代谢和肠道稳态
研究发现C. minuta DSM 22607以5:1的比例产生高水平的乙酸盐和中等水平的丁酸盐,而不产生丙酸盐。
同时,在近端和远端结肠中均发现了低水平的支链脂肪酸,即异丁酸、异戊酸和异己酸,这表明C.minuta可降低细菌蛋白水解并刺激碳水化合物发酵。
肠道菌群通过短链脂肪酸(SCFA)产生参与调节能量代谢和肠道稳态。SCFA 被吸收并充当宿主体内葡萄糖和脂质代谢的能量来源或前体。SCFA可能通过G蛋白偶联受体,即游离脂肪酸受体2(FFAR2)和3(FFAR3)与结肠、肝脏、肌肉和脂肪组织相互作用。
-调节瘦素水平,减少脂肪的生成
此外,短链脂肪酸会上调抑制饥饿的瘦素合成,抑制脂肪生成并促进脂肪分解。研究评估了丁酸盐的施用可以通过促进脂肪细胞形成和脂肪组织褐变来减少能量摄入,增强脂肪氧化和能量消耗,从而治疗和预防肥胖。
这些由肠道微生物群产生的短链脂肪酸还与结肠粘膜中的肠内分泌细胞相互作用,诱导释放胰高血糖素样肽1(GLP-1)和肽YY(PYY)。这些激素进入体循环并对许多器官和组织发挥作用,最重要的是胃和胰腺。GLP-1和PYY共同防止胃排空过快,抑制酸分泌和运动,减缓胃肠道运输,从而导致食欲减少和食物摄入量减少。GLP-1还能刺激胰岛素分泌并防止胰腺β细胞衰竭。
-C.minuta改善了肠道上皮完整性,增强肠道屏障
此外,C. minuta合成的两种短链脂肪酸可能都参与维持肠上皮屏障。例如,乙酸和丁酸可通过与G蛋白偶联受体GPR43和GPR109A 结合来激活核苷酸结合寡聚化结构域3(NLRP3)炎症小体,这会增加IL-18的释放,促进上皮细胞的修复。
丁酸能稳定缺氧诱导因子(HIF),后者是屏障保护和组织再生的关键分子,它上调紧密连接蛋白,增加杯状细胞的黏蛋白生成,从而增强肠道屏障。
一项研究表明,C. minuta在体外和涉及高脂饮食组的动物研究中改善了肠道紧密连接蛋白(ZO-1)、闭合蛋白(OCLN)和紧密连接蛋白-1(CLDN1)的表达。
肠道通透性增加被认为是脂肪诱导性肥胖的一个驱动因素,与肠道菌群失调和肠道炎症有关。已证实肥胖小鼠的紧密连接减少,这表明肥胖是由肠道通透性增加和跨上皮阻力降低引起的。
肠道紧密连接蛋白下调可导致肠道渗漏,其中脂多糖细菌物质和其他炎症介质通过紧密连接扩散并与宿主免疫细胞相互作用,导致低度炎症、暴食并最终导致体重增加。
-调节甘油三酯和游离脂肪酸的积累
此外,与肥胖水平或体脂相关的身体质量指数(BMI)也与肠道中C.minuta的丰富程度密切相关。调节脂肪酸的合成和氧化以及抑制脂肪生成对体脂和体重有有利的影响。
早期的一项研究表明,肠道微生物群中C.minuta的存在与肥胖降低之间存在联系。一项针对C.minuta的干预研究表明,在饮食诱导的肥胖小鼠模型中,肝脏甘油三酯和游离脂肪酸的积累受到阻碍。这一发现与基因表达水平一致,在补充了C.minuta的动物模型中,编码肝脏葡萄糖激酶的gck基因受到强烈抑制。
葡萄糖激酶的过度表达促进了糖的过度吸收、肝脏脂质积累和棕色脂肪组织(BAT)中产热蛋白的下调,导致肥胖。从机制上讲,增强BAT中的脂肪组织产热作用并诱导白色脂肪组织(WAT)褐变可导致体重减轻。
-通过调节胆汁酸代谢来发挥抗肥胖能力
胆汁酸代谢对于调节葡萄糖和能量代谢、肠道完整性和免疫力至关重要。胆汁酸代谢的改变与肥胖密切相关。胆汁酸代谢通过刺激脂肪酸氧化和抑制甘油三酯和肝脏脂肪酸的产生。
C.minuta的抗肥胖潜力还通过结肠中的胆酸/牛磺胆酸(CA/TCA)比率来展现。这一发现意义重大,为抗肥胖与糖分解代谢以及初级胆汁酸的有效解离之间的关联提供了重要的理论基础。
C.minuta菌株 DSM33407和DSM22607在80%胆汁存在48小时的情况下均对胆汁酸具有高度耐受性。胆汁酸水解酶(BSH)基因已在两种C.minuta菌株中被鉴定,并且由于其水解结合胆汁酸的强能力而高度表达。
C.minuta还通过法尼醇x受体和G蛋白偶联胆汁酸受体(TGR5)促进胆汁酸代谢,而 TGR5 在肠道中高度表达。一些体内研究表明,肠道生态系统中BSH的高水平表达被认为是抗肥胖的关键调节因素,可显著降低体重、肥胖、循环低密度脂蛋白(LDL)胆固醇和甘油三酯。
注:BSH活性是肥胖控制的关键机制目标。利用具有高BSH活性的细菌菌株来丰富肠道微生物群可能是预防和控制肥胖的一种策略。
▸ 炎症性肠病中减少 ↓
炎症性肠病(IBD)是一种影响胃肠道的慢性炎症性疾病,主要有两种类型:克罗恩病和溃疡性结肠炎,每种类型都有不同的生理症状。研究发现,IBD患者的微生物组成会发生变化,其特征是厚壁菌门与拟杆菌门的比例下降。
-抑制NF-κB信号通路和IL-8来减轻结肠炎症
肠道菌群失调伴有短链脂肪酸组成的变化,随后是肠道屏障完整性的破坏,最终通过免疫系统调节引发炎症反应。尽管 IBD 的病因仍不太清楚,但研究表明,它们是由不受控制的炎症反应引发的,与白细胞介素8(IL-8)细胞因子和活性氧(ROS)的增加有关。
许多研究已经证明克罗恩病(CD)和溃疡性结肠炎(UC)患者的Christensenellaceae会减少。在发作前立即观察到静止期CD患者中Christensenellaceae的丰度显著下降,这可能表明它们在疾病进展中发挥了作用。在腹泻患者中也观察到了Christensenellaceae的丰度较低。
最近的体外和体内研究表明,C.minuta具有强效抗炎和免疫调节特性。C. minuta通过抑制 NF-κB 信号通路和促炎细胞因子IL-8的分泌来减轻结肠炎症。
-克罗恩病患者缺乏C.minuta
一项对C.minuta的介入研究表明,克罗恩病(CD)患者中缺乏Christensenella minuta(C.minuta),并且有记录证明它们会在人类上皮细胞中诱导抗炎作用,这支持了它们作为一种新型生物疗法的潜力。
在两种不同的急性结肠炎动物模型和一种人类肠道细胞系中,C.minuta限制结肠损伤、促进粘膜愈合并降低因炎症引起的中性粒细胞(特别是髓过氧化物酶和嗜酸性粒细胞过氧化物酶)的活化。
在C.minuta治疗动物模型中,肠道炎症的非侵入性生物标志人脂质运载蛋白-2(LCN-2)的浓度降低。在基因层面,携带克罗恩病风险基因 IL23R 的个体体内与C.minuta相关的微生物丰度降低,表明肠道微生物组受到宿主遗传学的影响。
据报道,当小鼠补充C.minuta时,IL23R 保护性编码变体会增加,从而预防克罗恩病。C.minuta还会产生丁酸,通过丁酸受体 GPR109a 来控制脂肪细胞、肠上皮细胞和免疫细胞中的炎症反应。
值得注意的是,C.minuta的抗炎功效已被证实与美沙拉嗪(也称为5-氨基水杨酸(5-ASA),一种用于治疗IBD的药物)相似。
▸ 2型糖尿病患者中减少 ↓
2型糖尿病(T2D)是一种复杂的代谢和内分泌功能障碍,其特征是胰岛素抵抗、胰腺β细胞功能障碍、低度全身炎症、肠道菌群失调、肥胖和其他内分泌疾病引起的高血糖。
中药是一种源自天然产物的补充药物,在治疗代谢综合征方面具有潜力。口服中药干预会影响肠道微生物群,但由于其活性成分(如黄酮类化合物)的亲脂性较差,因此生物利用度较低。肠道菌群的生物转化促进药物的吸收,这对药理学有重大影响。
-增加C.minuta有助于改善糖尿病
中药成分可能会调节宿主肠道菌群的数量。黄芪苓化散(HQLHS)由黄芪、灵芝、桦褐孔菌和苦瓜组成,是专门用于治疗2型糖尿病的中药复方。
最近的一项研究表明,在小鼠模型中,HQLHS抑制了致病菌并丰富了有益菌,特别是C.minuta和Christensenella timonensis。值得注意的是,该研究表明HQLHS显著增加了小鼠肠道菌群中Christensenella的相对丰度。该研究还描述了C.minuta对肝脏代谢的影响,为理解C.minuta在糖尿病治疗和控制中的药理机制奠定了基础。
-减少氧化应激、改善葡萄糖代谢
在同一项研究中,C. minuta DSM 22607 降低了糖尿病大鼠体内的氧化应激、色氨酸和酪氨酸等糖尿病诱因。抗氧化酶和脂质过氧化生物标志物 MDA 的水平也得到了控制。
C. minuta的抗糖尿病特性有多种机制,例如改善糖脂代谢、通过抑制肠道葡萄糖转运中SGLT1和GLUT2的表达来抑制葡萄糖吸收、促进GLP-1分泌以刺激胰岛素抵抗并调节葡萄糖稳态。
▸ 支气管哮喘和过敏性疾病中减少 ↓
-C.minuta丰度较高时患哮喘的可能性较低
小克里斯滕森氏菌(Christensenella minuta)还与支气管哮喘和过敏性疾病有关。研究发现,粪便微生物组中富含C. minuta的儿童患湿疹和对吸入性过敏原致敏的可能性较小。
值得注意的是,家庭环境中克里斯滕森菌科的丰富程度可能在支气管哮喘中发挥重要作用。分析了从健康儿童以及患有哮喘的儿童和成人家中收集的灰尘的宏基因组学谱。他们发现,克里斯滕森菌科在“健康”房屋的灰尘中显著过多,而在“哮喘”房屋的灰尘中却很少。
其他一些研究还发现:肾结石、情感障碍、甲状腺癌、粘膜类天疱疮、多囊卵巢综合征和复发性口疮性口炎也与Christensenellaceae科丰度较低有关。
▸ 过高在一些患者中可能有害 ↑
然而,有证据表明,Christensenellaceae科的丰度较高可能与一些病理之间存在联系。在一项研究中,Christensenellaceae科的丰度较高会增加重症监护病房中患有神经系统疾病的危重患者的死亡风险。
该分类单元在帕金森病患者中显著富集,尤其是在临床特征较差的患者中。在患有阿尔茨海默病、多发性硬化症和神经性厌食症的人中也观察到了Christensenellaceae科的丰富度增加。
04 与其他细菌的相互作用
C.minuta和Christensenellaceae科的有益作用可能归因于它们与肠道中许多其他细菌群落相互作用的特殊能力。除了直接作用外,C.minuta还可以通过促进或限制某些分类群的生长来间接影响宿主。
-与Christensenellaceae正相关的菌群
Christensenellaceae与许多菌群呈正相关,包括:
颤螺菌属(Oscillospira)
瘤胃球菌属(Ruminococcus)
粪球菌属(Coprococcus)
普雷沃氏菌属(Prevotella)
嗜粘蛋白-阿克曼氏菌(Akkermansia muciniphila)
罗氏菌属(Roseburia)
-与Christensenellaceae负相关的菌群
相反,几个属与Christensenellaceae呈负相关:
克雷伯氏菌属(Klebsiella)
链球菌属(Streptococcus)
梭杆菌属(Fusobacterium)
经黏液真杆菌属(Blautia)
Magamonas
▸ 能够促进一些有益菌的生长
此外, Christensenellaceae丰度越高,微生物丰富度和多样性就越高。值得注意的是,几种与之呈正相关的菌群已被提议作为新一代益生菌(Oscillospira、Roseburia)或目前已经是这种身份(Akkermansia)。
链接()
-C.minuta能够促进双歧杆菌生长
C.minuta能够促进双歧杆菌属的生长,这是通过产生代谢产物如短链脂肪酸(SCFAs),特别是乙酸和丁酸,这些SCFAs是双歧杆菌属的重要能量来源。这种交叉喂养关系有助于双歧杆菌属在肠道中的定植和增殖。
-C.minuta塑造适合乳酸杆菌生长的环境
C.minuta可能通过产生乳酸来降低肠道pH值,从而为乳酸杆菌属创造一个更适宜的生长环境。此外,C.minuta产生的代谢产物可能直接或间接地激活乳酸杆菌属的代谢途径,增强其在肠道中的竞争力。
-C.minuta促进普拉梭菌生长
Faecalibacterium prausnitzii是一种潜在的下一代益生菌,具有高丁酸生产、抗炎和预防肠道病原体的作用。
研究发现,Christensenella minuta通过产生外源乙酸、半胱氨酸、脯氨酸和赖氨酸来交叉喂养F.prausnitzii,这些都是F. prausnitzii发酵和繁殖所必需的。从而促进了Faecalibacterium prausnitzii的增殖。
-C.minuta与粪肠球菌
C.minuta与F.prausnitzii之间存在正向的相互作用。C.minuta产生的代谢产物可能作为F.prausnitzii的底物,促进其生长和SCFA的生产,特别是丁酸盐,这是一种对肠道健康至关重要的短链脂肪酸。
▸ 减少一些有害菌群
有趣的是,在存在Christensenellaceae的情况下通常会减少几种有害菌群,例如机会性病原体,已知会导致人类和动物感染的克雷伯氏菌和链球菌,以及可能导致癌症的微生物梭杆菌。
因此,我们假设C. minuta可以通过支持有益物种的生长和抑制潜在有害物种来调节肠道微生物群。
-C.minuta抑制克雷伯菌的定植
C.minuta可能通过竞争营养物质或产生抗菌物质来抑制K.pneumoniae等潜在的病原菌。这种竞争和抑制作用有助于维持肠道微生物群的平衡,防止病原菌的过度生长。
-C.minuta限制大肠杆菌的增殖
C.minuta可能通过调节肠道中的氧化还原电位来影响大肠杆菌的生长。由于C.minuta是严格的厌氧菌,它可能通过降低肠道的氧化还原电位来限制需氧菌如大肠杆菌的增殖。
▸ 与甲烷杆菌存在互作并可能影响体重
不同细菌种属很可能通过代谢物转移进行相互作用。Christensenellaceae科和甲烷杆菌科的相互作用可能影响体重指数并呈负相关。
对来自10项独立研究的1821个样本进行了荟萃分析,证实了在科水平(Christensenellaceae科和甲烷杆菌科)和种水平(C.minuta和Methanobrevibacter smithii)之间均存在很强的正相关性。
此外,发现了它们之间的物理和代谢相互作用。作为一种氢气生产者,C.minuta有效地支持了依赖氢气供应的M.smithii的生长。在共同培养时,C.minuta释放的氢气量足以确保M.smithii的生存力,与氢气过量的单一培养中相当。
反过来,M.smithii也能调节C.minuta的代谢,导致短链脂肪酸的产生从丁酸转向乙酸。根据观察到的乙酸盐产量的增加。除此之外,甲烷杆菌科的甲烷生产会导致碳损失和宿主可用能量减少,这可能部分解释了该细菌与体重减轻之间的关联。
05 作为益生菌的依据
Christensenellaceae可能是一种高效益生菌药物的来源,可使许多患者群体受益,尤其是那些患有代谢紊乱和炎症性胃肠道疾病的患者。我们在下面总结了C.minuta作为益生菌在人体健康中的一些作用。
▸ 抗炎作用
C.minuta益生菌活性的所有潜在机制尚未完全了解;不过,已经取得了许多积极的进展。在一系列体外和体内实验中测试了C. minuta DSM 22607。首先,该细菌及其上清液均表现出强大的抗炎潜力,因为它们能够限制HT-29细胞中的IL-8产生,此外发现上清液还能抑制NF-kB信号通路。
从9位捐献者身上分离并测试了 32 株新的C.minuta菌株,以确定最佳候选益生菌药物。他们在一系列实验中分析了这些菌株的抗炎和保护特性,并选出了5种主要候选菌株。五种候选菌株均在体外细胞模型中阻止TNF-α刺激后的NF-kB通路激活并诱导IL-10的产生。
在动物模型中,五种菌株中的两种显著改善了TNBC引起的炎症病变,并具有明显的局部抗炎作用。
此外,还证明了C.minuta菌株在体外模型中刺激人源 PBMC 产生 IL-10的能力。
▸ 保护肠道屏障
其次,C.minuta还显示出保护 TNF-α 受损的 Caco-2 细胞中肠道屏障的能力。这些结果在二硝基苯磺酸(DNBS)和三硝基苯磺酸(TNBS)诱发的结肠炎小鼠模型中得到了证实。
在这两项实验中,C.minuta表现出独特的抗炎特性,保护结肠组织的效果与5-氨基水杨酸(5-ASA)一样有效。该细菌减少了宏观和微观化学损伤,减少了结肠中的免疫细胞浸润(ICI),限制了氧化应激,并降低了促炎细胞因子的分泌和脂质运载蛋白-2的表达。
▸ 能够产生乙酸盐、丁酸盐
实验还揭示了C. minuta的代谢作用,特别是其产生大量乙酸盐和适量丁酸盐的能力。据报道, C.minuta可以同时产生短链脂肪酸(SCFA)中的乙酸盐和丁酸盐,而大多数微生物只能产生丁酸盐或乙酸盐其中一种。
▸ 抗肥胖能力
对C.minuta DSM22607 的抗肥胖能力进行了研究。他们发现,每天施用2×10^9个C. minuta菌落形成单位(CFU)可防止喂食高脂饮食(HFD)的小鼠体重增加和高血糖,但不影响它们的食物摄入量。
令人惊讶的是,食用益生菌菌株的动物和喂食正常食物的动物在体重增加方面没有统计学上的显著差异;然而,接受载体的HFD喂养小鼠体重增加明显且快速。这强烈表明C.minuta通过改变新陈代谢而不是影响进食行为来限制脂肪堆积。
这些发现与对血清代谢标志物的观察结果相关,即高脂饮食小鼠的瘦素和抵抗素水平下降。C.minuta可能破坏了肝脏脂肪生成,这通过编码葡萄糖激酶的Gck基因表达降低来证明。
此外,益生菌菌株通过上调编码主要紧密连接蛋白的Ocln和Zo1基因,对肠道通透性具有强大的保护作用。这也可能有助于C. minuta通过限制由肠漏引起的全身炎症而发挥抗肥胖作用。
▸ 改善糖尿病
进一步证实了C. minuta的有益作用及其在代谢过程中的关键作用的证据。使用两种Christensenella属菌株(C.minuta DSM 22607 和C.timonesis DSM 102800)治疗小鼠2型糖尿病,两种菌株均改善了许多代谢指标。
管饲益生菌可降低血糖水平、限制氧化应激、促进受损胰岛和肝细胞的修复,并抑制肝脏和结肠中几种促炎细胞因子和 TLR4 的表达。
重要的是,用C.minuta和C.timonesis治疗还上调结肠中的Zonula occludens-1和Claudin-1,从而加强肠道屏障。测试对象血清脂多糖水平下降支持了这一发现。这两种菌株还通过刺激胰高血糖素原的表达、增加血清胰高血糖素样肽-1(GLP-1)水平和限制肝糖异生,对代谢产生了重大影响。
总体而言,C.minuta和C.timonesis改善了2型糖尿病的代谢过程并减轻了炎症反应。
▸ 免疫调节作用
C.minuta能够通过调节肠道微环境影响宿主的免疫系统。研究表明,C. minuta能够促进Th17细胞的分化,这些细胞在维持肠道免疫耐受和防御病原体入侵方面发挥着关键作用。
此外,C.minuta还可能通过与其他肠道共生菌的复杂相互作用,间接影响宿主的免疫系统。肠道微生物群落之间的相互作用是复杂的,C.minuta通过其代谢产物和分泌物,可以影响其他菌群的生长和功能,进而调节宿主的免疫反应。这种间接调节机制为宿主免疫系统提供了额外的调节途径。
最后,C.minuta对宿主免疫系统的调节作用可能还与其在肠道中的定植能力有关。研究表明,C.minuta在人体肠道中具有较高的遗传性,这意味着它能够有效地定植并长期存在于宿主肠道中。这种定植能力可能是C. minuta发挥其免疫调节作用的基础。
▸ 增加有益菌丰度,改善肠道菌群组成
此外,Christensenella菌株通过增加许多有益微生物(如双歧杆菌和Phascolarctobacterium)的丰度来改变肠道微生物群的组成。
06 调节C.minuta的策略
调节C.minuta的策略可以通过多种途径实现,包括饮食调节、益生菌和益生元的使用、药物治疗以及功能性食品的摄入。
▸ 通过饮食调节C.minuta的策略
调节肠道共生菌C.minuta的一种有效方法是通过饮食。
研究表明,某些食物成分可以促进C.minuta的生长和活性。例如,高纤维食物,如全谷物、豆类、坚果和水果,可以作为益生元,为C.minuta提供必要的营养物质。这些纤维在肠道中被微生物发酵,产生短链脂肪酸,这些物质对C.minuta的生长至关重要。
此外,一些特定的益生元,如低聚果糖和菊粉,已被证明能够特异性地增加C.minuta的数量。
▸ 益生元和合生元的应用
益生元是指能够促进肠道内有益菌生长的非消化性食品成分,而合生元则是益生元和益生菌的组合。在调节C.minuta中,益生元和合生元的应用是两个重要的策略。
益生元如多糖、半纤维素、果胶等,能够通过刺激C.minuta的生长,增强其在肠道中的竞争力。合生元则结合了益生元和益生菌的双重优势,通过提供C.minuta所需的营养物质和直接补充C.minuta,更有效地调节肠道微生物群。
▸ 药物和功能性食品的作用
在某些情况下,药物和功能性食品也可以用于调节C.minuta。例如,某些抗生素可以在必要时用来减少有害菌的数量,为C.minuta提供更好的生长环境。
功能性食品,如含有特定益生菌的酸奶或补充剂,可以直接补充C.minuta,增加其在肠道中的数量。此外,一些植物提取物和天然化合物也被研究用于调节肠道微生物群,包括C.minuta。
- 上一篇:小鸡拉稀的原因与有效治疗方法 [2025-01-02]
- 下一篇:微生物之间的相互作用及其类型,示例展示介绍 [2025-01-02]







